
技術文章
 更新時間:2025-09-05
更新時間:2025-09-05 點擊次數:24
點擊次數:24
在生物醫學研究領域,類器官正憑借其優勢改變著科研格局。作為由干細胞或多能干細胞經三維培養形成的微型組織模型,類器官能高度模擬體內器官的結構與功能,在疾病建模、精準醫學、藥物篩選及再生醫學等領域展現出巨大應用潛力。比如肝細胞類器官為肝臟移植提供了新平臺,呼吸道類器官還成功實現了人鼻病毒 C 的連續傳代培養,解決了傳統細胞系中難以培養該病毒的難題。
相較于傳統 2D 細胞培養無法模擬組織微環境、動物模型存在物種差異及倫理限制的局限性,類器官在保留組織異質性、維持基因組穩定性方面優勢較高,被視作替代傳統模型的 “活體生物庫"。但類器官技術的廣泛應用,卻受限于長期培養過程中的關鍵瓶頸 —— 傳代操作。傳代是維持類器官持續擴增與功能穩定的核心環節,其效率直接決定實驗的可重復性與研究進展。
當前,像肝癌、甲狀腺癌這類難養類器官,在傳代過程中普遍面臨活性不足、結構破壞等問題,有數據顯示肝癌類器官傳代后存活率不足 40%,導致這類模型難以用于長期實驗研究。此外,傳代過程中細胞存活率低、增殖效率差等問題,也制約著胰腺癌等疾病模型的研究進程,優化傳代技術已迫在眉睫。
傳代技術的核心挑戰主要體現在三個方面:一是機械或酶解分離容易破壞類器官結構完整性;二是消化時間與力度控制不當會導致細胞活性下降;三是傳代后基質包埋與培養條件適配性不足,影響后續增殖效率。這些問題在干細胞來源的復雜類器官(如肝 / 胰腺共祖細胞衍生模型)中更為突出,直接限制了其從基礎研究向臨床轉化的應用。
基于此,深入分析類器官傳代的關鍵技術節點,建立標準化操作流程,提供試劑盒選擇的科學依據,探討技術優化路徑,對于解決難養類器官傳代困境、推動類器官技術在精準醫學與再生醫學領域的規范化應用具有重要意義。
想要提升類器官傳代效率,需精準把控消化、離心、基質膠處理等關鍵環節,具體技術要點如下:
• 消化體系:采用機械分散與酶解結合的方式,先通過 200μm 濾網過濾進行機械分散,再用 0.25% Trypsin-EDTA 在 37℃條件下孵育 5 分鐘,實現類器官的有效分離。
• 離心條件:使用 4℃預冷的離心機,以 200×g 的轉速離心 5 分鐘,離心完成后棄去上清液,用培養基重懸沉淀,保留細胞活性。
• 基質膠處理:基質膠需在冰上融化,之后與細胞懸液按 1:3 的體積比混合,同時要確保每孔接種密度達到 5×10?個細胞,為類器官后續生長提供良好基礎。
類器官傳代技術的發展,見證了 3D 細胞培養從依賴經驗到標準化、精準化的轉變。早期傳代操作高度依賴研究者經驗,比如用手動刮除基質膠的物理分離方式,容易造成細胞機械損傷;酶消化時間僅靠肉眼判斷,主觀性強,常出現消化過度或不充分的情況,直接影響細胞存活率與類器官結構完整性。這種粗放式操作導致不同實驗室、甚至同一實驗室不同批次的傳代結果差異明顯,嚴重制約了類器官技術的可重復性與轉化進程。
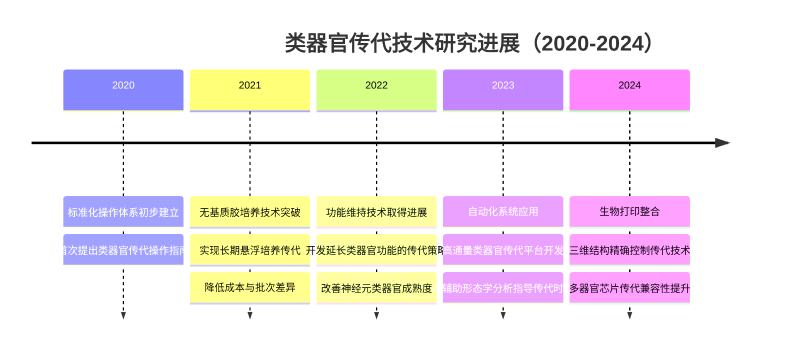
近五年,類器官傳代技術在標準化與效率提升方面取得多項關鍵突破,形成了多維度的技術革新:
1. 標準化操作體系構建:消化酶與傳代參數的優化是流程標準化的核心。TrypLE™系列等胰蛋白酶替代產品,憑借更溫和的酶解特性,大幅降低了傳統胰酶對細胞表面受體的破壞;傳代比例控制(1:2-1:4)與機械分散技術結合,實現了腸道、肝等常規類器官的穩定傳代。此外,食管類器官還建立起包含 Dispase 消化、胰蛋白酶解離及 40μm 過濾器過濾的三步標準化流程,將原代組織的傳代成功率提升至 85% 以上。
2. 無基質膠培養與水凝膠體系革新:同濟大學開發的 BEX 擴增體系打破了傳統基質膠的限制,該體系通過 5-DPM 培養基(含 RG108、A83-01、毛喉素等小分子抑制劑與 RSPO1 生長因子)與 HAHS 水凝膠的組合,實現了膽管類器官在 60 天內 3000 倍擴增,且可穩定傳代 20 代以上。通過成分確定的化學微環境調控,該體系避免了基質膠批次差異帶來的干擾,為膽管疾病建模與藥物篩選提供了穩定的體外模型。
3. 功能維持與精準調控技術:日本研究團隊發現,OSM(Oncostatin M)可通過激活 STAT3 通路,顯著提升肝細胞類器官的代謝功能維持能力,使傳代后細胞的尿素合成與藥物代謝活性保留率提高 40% 以上。在病毒研究領域,呼吸道類器官通過引入 CYT387 抑制干擾素通路,實現人鼻病毒 C 在氣道上皮類器官中的連續 5 次傳代,而鼻類器官更展現出自發支持病毒傳代的優勢,為呼吸道病毒致病機制研究提供了全新工具。
4. 自動化與專用試劑系統開發:針對傳代痛點,相關廠商推出了專用試劑盒,大幅降低了操作門檻。例如含鼠源特異性生長因子的培養基,可精準匹配腸道干細胞的自我更新需求;生物相容性水凝膠凍存試劑,能將類器官凍存復蘇后的存活率提升至 90% 以上。最新研究顯示,通過分群結構分析、時序分群占比密度矩陣構建及生長函數修正的自動化傳代控制系統,可實現傳代時機的精準判斷,使培養效率提升 35%。
不同類器官特性不同,適用的傳代方法也存在差異,具體選擇可參考以下指南:
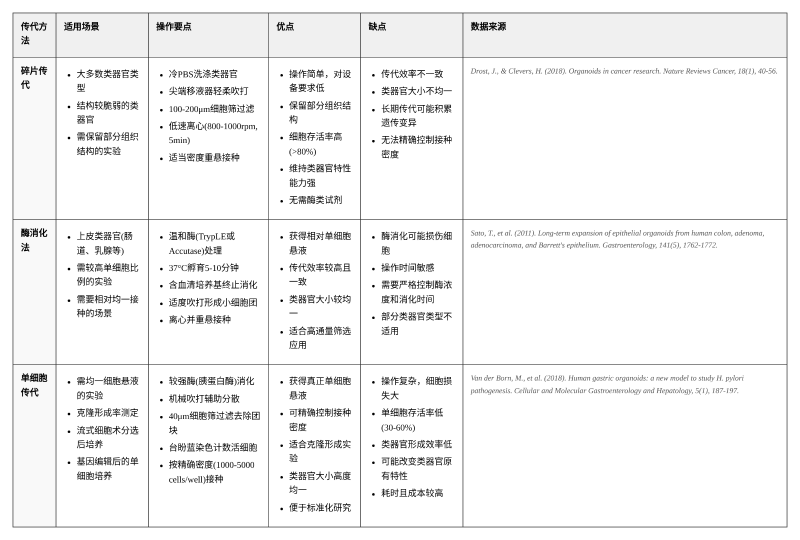
• 碎片傳代:是多數類器官的重要方法,通過機械吹打獲得 50-200μm 的細胞團塊,既能兼顧細胞活性,又能保留其分化潛力。
• 酶消化法:適用于緊密連接的上皮類器官,常用 Tryple™Express 酶,操作時需嚴格控制消化時間,通常為 5-10 分鐘。
• 單細胞傳代:僅推薦用于克隆培養,且需添加 ROCK 抑制劑,以減少單細胞凋亡。
盡管類器官傳代技術迭代迅速,但仍面臨兩大核心挑戰。一方面,傳代參數缺乏統一標準:肝癌類器官需 1:2 高比例傳代以維持增殖活性,而甲狀腺癌類器官則需 1:4 低比例傳代避免過度擁擠,這種組織特異性差異導致跨實驗室數據可比性差。另一方面,試劑盒兼容性不足:現有商用試劑盒多針對腸道、乳腺等常見類器官開發,對膽管、胰腺等特殊類型類器官的支持度有限,
近年來,國產類器官培養試劑盒也是層出不窮,比如濟研的鼠源類器官一站式構建及傳代試劑盒、類器官專用組織包埋膠(SE-Gel)等,采用納米級親水涂層微孔板,支持鼠源類器官懸浮培養,無需基質膠包埋,傳代時直接收集細胞球,避免酶解損傷,細胞存活率提升至 90% 以上;傳代后細胞倍增時間縮短至 24-36 小時(傳統培養基需 48-72 小時);經 10 + 種鼠源腫瘤類器官(如胃癌、卵巢癌)傳代驗證,結構完整率達 85% 以上,為后續標準化流程設計與試劑盒選擇指南提供了現實依據。
更多類器官培養試劑,基質膠,類器官培養基,試劑盒等實驗耗材請進入蘇州阿爾法生物進行了解。